Hur man beräknar bindningsorder och bandlängd
 Share
Share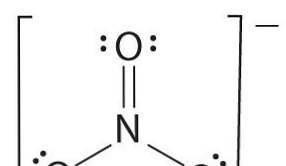
Att bestämma vissa parametrar som storlek, längd och vinkel i atomskala är inte lätt. På grund av de viktiga av dessa parametrar har forskare utvecklat metoder för att härleda eller beräkna parametrarna på atomnivå. Obligationsorder och bindningslängd är två sådana viktiga parametrar som indikerar typen och styrkan hos bindningar mellan ett par atomer.
Denna artikel förklarar,
1. Vad är Bond Order och Bond Length
2. Hur man beräknar Obligationsorder och Obligationslängd
- Hur man beräknar bindningsorder
- Hur man beräknar bindningslängd
Vad är Bond Order och Bond Length
Bondlängd och bindningsordning är två parametrar som är associerade med kovalenta bindningar. Bondorder är antalet kemiska bindningar mellan två atomer och bindningslängden är avståndet mellan två kärnor av atomer som är kovalent bundna ihop.Denna artikel förklarar hur man beräknar bindningsordning och bindningslängd på en atomnivå.
Hur man beräknar bindningsorder
Bondorder är antalet kemiska bindningar mellan två atomer. Det indikerar stabiliteten hos ett band. I kovalenta bindningar är bindningsordern antalet delade elektroner. Exempelvis är bindningsordningen för ett par atomer bundna av ett enkelbindning en, medan bindningsordningen för ett par atomer bundna av en dubbelbindning är två. Nollbindningsorder indikerar att det inte finns någon bindning mellan atomer. Stabiliteten hos en molekyl ökar med ökande bindningsordning. Molekylerna med resonansbindning behöver inte vara ett heltal. I kovalenta föreningar med två atomer bestäms bindningsordningen mellan ett par atomer genom att först dra Lewis-strukturen och sedan bestämma typen av bindningar mellan atomerna - nollbindning, enkel-, dubbel- eller trippelbindning. Exempelvis bestäms bindningsordningen för vätegas enligt följande.
- Rita Lewis-strukturen
H: H
- Bestäm antal bindningar / par valenselektroner
Ett par elektroner, följaktligen är bindningsordningen 1.
Om det finns mer än två atomer bestäms bindningsordningen enligt följande. Se exemplet: nitratjon.
- Rita Lewis-strukturen

- Räkna det totala antalet obligationer (enligt nitratjon, dess 4)
- Antalet bindningsgrupper mellan enskilda atomer (enligt ammoniak, dess 3)
- Därför är obligationsordern = Totalt antal obligationer / antal obligationsgrupper
= 4/3
= 1,33
Därför är bindningsordningen för nitratjon 1,33
Hur man beräknar bindningslängd
Bondlängden är avståndet mellan två kärnor av atomer som är kovalent bundna ihop. Bondlängden ligger vanligen inom intervallet 0,1 till 0,2 nm. När två liknande atomer är bundna samman kallas hälften av bindningslängden som kovalent radie. Bondlängden beror på antalet bundna elektroner av två atomer eller bindningsordningen. Ju högre bindningsordningen, kortare bindningslängden kommer att bero på starka dragkrafter av positivt laddade kärnor. Obligationslängdenheten är picometer. I singel-, dubbel- och trippelbindningar ökar bindningslängden i storleksordningen
trippelbindning Elektronegativitet kan användas för att beräkna bindningslängden mellan två atomer som har olika elektronegativiteter. Följande empiriska formel föreslogs av Shoemaker och Stevenson för att beräkna bindningslängden. dA-B = ren + rB - 0,09 (xen - xB) dA-B är bindningsavstånd mellan två atomer A och B, ren och rB är kovalenta radier av A och B, och (xen - xB) är elektronegativitetsskillnaden mellan A och B. En annan metod används för att beräkna den ungefärliga obligationslängden. I denna metod dras första Lewis-strukturen för att bestämma den kovalenta bindningstypen. Använd sedan ett diagram * gjort på studierna gjorda av Cordero et al., och Pyykkö och Atsumi, motsvarande radier av bindningarna som gjorts av varje atom bestäms. Då bestäms bindningslängden genom att ta summan av de två radierna. När man till exempel bestämmer bindningslängden för koldioxid ritas den första Lewis-strukturen. Enligt diagrammet är den kovalenta raden av kol dubbelbindning 67 picometrar och den för syre dubbelbindning är 57 picometrar. Därför är bindningslängden för koldioxid ungefär 124 picometrar (57 pm + 67 pm). * Kovalent diagram finns här Referens: Cordero, Beatriz, et al. "Kovalent radier revisited." Dalton Transactions 21 (2008): 2832-2838. Libretexts. "Bond Order och Lengths." Chemistry LibreTexts. Libretexts, 05 december 2016. Web. 10 januari 2017. Lister, Ted och Janet Renshaw. Förstå kemi för avancerad nivå. NP .: Nelson Thornes, 2000. Print. Pratiyogita Darpan. "Egenskaper av element i samband med deras elektroniska struktur." Konkurrensvetenskapssyn Aug. 1998: n. pag. Skriva ut. Pyykkö, Pekka och Michiko Atsumi. "Molekylär dubbelbindningskovalent radii för element Li-E112". Kemi-En europeisk tidskrift 15.46 (2009): 12770-12779.
